* Xét bề mặt hệ dị thể gồm pha lỏng và pha khí. Mật độ phân tử trong pha lỏng lớn hơn nhiều so với trong pha khí. Các phân tử nằm trong pha lỏng tác dụng lên nhau bởi lực hút phân tử, lực này trong pha khí có thể bỏ qua. Lực hút phân tử chỉ tác dụng trong một khoảng cách nhất định, bằng bán kính hiệu dụng của phân tử (rhd~10-7 cm).
– Xét ba phân tử A, B, C. Gọi d là khoảng cách từ tâm phân tử đến bề mặt thoáng, ta thấy dA > rhd ; dB < rhd ; dC ~ 0 , (dC<rhd)
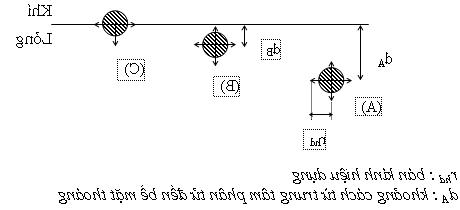
Phân tử A nằm ở trong lòng pha lỏng chịu các lực hút như nhau về mọi phía. Trái lại, phân tử B và C có d < rhd nên chịu lực hút vào trong lòng thể tích pha lỏng lớn hơn lực hút ra phía ngoài pha khí. Các phân tử này có khuynh hướng bị hút vào trong lòng pha lỏng. Độ lớn của lực này càng tăng khi phân tử B càng tiến gần bề mặt thoáng. Lực ép các phân tử B, C và các phân tử nằm trên bề mặt vào trong gọi là nội áp. Nội áp kéo các phân tử chất lỏng vào trong, theo hướng vuông góc với bề mặt nên có xu hướng làm cho bề mặt giảm đến tối thiểu trong những điều kiện nhất định.
Chất lỏng càng phân cực nội áp càng lớn (ví dụ nội áp của nước là 14 800 atm, của benzen là 3 800 atm).
Lực tác dụng lên một đơn vị chiều dài của ranh giới phân chia và làm giảm bề mặt chất lỏng được gọi là sức căng bề mặt. Lực hút đó luôn có hướng tiếp tuyến với bề mặt chất lỏng. Đơn vị của đại lượng này là dyn/cm.
* Mặt khác các phân tử ở lớp bề mặt có thế năng lớn hơn thế năng của các phân tử nằm bên trong. Phần năng lượng lớn hơn đó gọi là năng lượng dư bề mặt của chất lỏng (hay là năng lượng tự do bề mặt, ký hiệu là ES). Gọi diện tích tổng cộng của bề mặt là S thì giữa S và ES có mối liên hệ : ES = σ . S
Hệ số tỉ lệ σ được gọi là năng lượng tự do của một đơn vị diện tích bề mặt, hay năng lượng tự do riêng bề mặt (ta thấy khi S = 1 thì σ = ES). Đơn vị đo của đại lượng này là erg/cm2.
* Để tăng bề mặt chất lỏng phải tiêu hao một công để thắng áp suất nội. Công này chỉ dùng để thắng lực tương tác giữa các phân tử, nên nó phải tỷ lệ với độ tăng diện tích tiếp xúc. Trong điều kiện đẳng nhiệt, thuận nghịch, chất lỏng là đơn cấu tử, thì công đó bằng độ tăng của năng lượng dư bề mặt. Ta có: W = dES = σ . dS
Vậy trong trường hợp hệ đơn cấu tử thì năng lượng bề mặt tự do riêng về giá trị bằng sức căng bề mặt, cùng ký hiệu là σ.
Chúng ta có thể hình dung: Sức căng bề mặt là lực tác dụng kéo một màng tưởng tượng (giống một màng đàn hồi) trên bề mặt chất lỏng. Đứng về mặt năng lượng mà xét thì chúng ta có thể tính SCBM qua thí nghiệm sau:
Nhúng khung hình vuông cạnh dài l vào dung dịch xà phòng rồi rút ra, trên khung sẽ có màng xà phòng hai mặt tạo thành. Để màng xà phòng khỏi co lại, cần tác động lên cạnh MN một lực f đúng bằng sức căng bề mặt. Khi dịch chuyển cạnh MN một đoạn dh thì diện tích bề mặt tăng lên một giá trị là: dS = 2. l. dh (vì màng xà phòng có hai mặt ngoài ở hai phía của khung). Công thực hiện quá trình: W = f .dh
Công đó dùng để tăng bề mặt lên một diện tích là dS, tức là làm tăng năng lượng bề mặt của quá trình lên một giá trị là dE S .
Vậy ta suy ra: W = dE S = σ . dS = 2. σ .l. dh
f .dh = 2. σ .l. dh
σ = f2.l size 12{ { {f} over {2 “.” l} } } {} Ta thấy sức căng bề mặt σ của một chất lỏng hay rắn là năng lượng tạo ra một đơn vị bề mặt cũng chính là lực kéo căng tác dụng lên một đơn vị chiều dài của ranh giới bề mặt phân chia pha giữa chất đó và chất khác .
Thứ nguyên của σ là erg . cm-2 = dyn . cm . cm-2 = dyn . cm-1
Dưới tác dụng của sức căng bề mặt, chất lỏng khi không có tác dụng của ngoại lực luôn có dạng hình cầu vì hình cầu có bề mặt là nhỏ nhất trong các hình có cùng thể tích và do đó khi ấy năng lượng bề mặt của giọt lỏng là tối thiểu, giúp nó tồn tại bền.
* Giá trị của sức căng bề mặt phụ thuộc vào bản chất của các pha tiếp xúc, nhiệt độ và lượng chất hòa tan. Khi tương tác giữa các phân tử của chất càng lớn thì công cần để thắng lực gây nên nội áp càng lớn do đó sức căng bề mặt càng lớn. Do tương tác phân tử giữa các pha khác nhau nên sức căng bề mặt của nước tiếp xúc với hơi nước sẽ có giá trị khác với sức căng bề mặt cũng của nước với bề mặt tiếp xúc là chất khác.
Chất rắn có sức căng bề mặt rất lớn và không cố định. Ví dụ: NaCl có σ trong khoảng 150- 870 erg/cm2. Kim cương có σ trong khoảng 11 000- 39 000 erg/cm2. Sức căng bề mặt của chất rắn rất khó xác định và phụ thuộc vào mạng tinh thể.
Chất lỏng càng phân cực thì sức căng bề mặt càng lớn. Khi nhiệt độ tăng, σ của đa số chất lỏng giảm xuống gần như tuyến tính vì tương tác giữa các phân tử yếu đi và ở nhiệt độ tới hạn khi ranh giới giữa các pha mất đi thì σ = 0. Điều này đúng cho hệ lỏng – khí lẫn cho hệ lỏng – lỏng, sức căng bề mặt mất đi ở nhiệt độ tới hạn hòa tan.
* Sức căng bề mặt cũng như năng lượng tự do bề mặt là những đại lượng có thể sử dụng cho cả trường hợp có hai chất lỏng không tan lẫn vào nhau, song ở đây mức độ cân bằng của các lực tương tác phân tử không lớn như trường hợp bề mặt phân chia pha lỏng – khí.
Bảng dưới đây cho biết sức căng bề mặt trên ranh giới lỏng – khí (σo)
và ranh giới lỏng – nước của một số chất (σ1).
Chất lỏng σo , erg/cm2, 20o C σ1, erg/cm2, 20o C Thủy ngân 471,60 – Nước 72,75 – Acid acetic 27,60 – n-Octanol 27,50 8,50 Rượu etylic 22,30 – n- Octan 21,80 50,80 n- Hexan 18,40 51,10
* Theo hệ quả của nguyên lý II nhiệt động học, mọi quá trình chỉ tự xảy ra theo chiều giảm năng lượng tự do, các quá trình bề mặt cũng vậy, chúng tự diễn ra khi mà ES giảm. Điều này có nghĩa quá trình bề mặt sẽ tự xảy ra khi ΔES < 0 tức là σ . ΔS < 0 theo một trong hai khuynh hướng:
- Nếu σ > 0 và không đổi thì phải có ΔS < 0: đó là khi bề mặt của hệ bị giảm xuống, hiện tượng này thường thấy trong sự keo tụ, sự kết tinh lại của hệ keo.
- Nếu ΔS không đổi thì bắt buộc biến thiên σ < 0, hiện tượng này thường xảy ra trong các quá trình hấp phụ dương. Sự giảm năng lượng tự do mà không cần phải làm giảm bề mặt phân cách xảy ra khi thêm vào hệ một cấu tử thứ ba nào đó (ngoài hai cấu tử là pha phân tán và môi trường phân tán) sao cho cấu tử này có thể được hấp phụ lên bề mặt hạt và làm giảm sức căng bề mặt của hạt. Cấu tử thứ ba này được gọi là chất làm bền (hay chất ổn định). Cân bằng đạt được trong trường hợp này là một cân bằng giả bền, và hệ thường giữ được độ bền vững (độ phân tán) trong một thời gian nhất định.